Введение.
Скрининг рака легкого при помощи низко-дозовой КТ способствует повышению выявляемости рака легких на ранних стадиях. В данной статье рассмотрены основные позиции по скринингу рака легкого при помощи низко-дозовой КТ в Европейском союзе такие, как
- группы риска
- полуавтоматическое определение узлов с последующей оценкой времени удвоения объёма (VDT)
- технические стандарты выполнения НДКТ вовремя скрининга.
- тактика ведения солидных не-кальцифицированных узлов, которые в объёме более, чем 300 мм3
- тактика ведения новых солидных узлов, которые в объёме более, чем 200 мм3

Диагностические тесты для выявления рака легкого.
В 1980 году в качестве скрининга рака легкого использовалась рентгенография органов грудной полости. Справа в таблице представлены пилотные проекты по скринингу рака легких при помощи НДКТ, из которых наивысшую эффективность показал проект NELSON, снизив смертность на 20% в первый год использования в сравнении с рентгенографией грудной полости. Помимо NELSON в Европейском союзе эффективность скрининга рака легких и экономиночность доказали следующие проекты:
- DANTE,
- DLCST,
- ITALUNG,
- LUSI,
- MILD,
- UKLS.
Похожие проекты в Канаде и США также доказали эффективность НДКТ при скрининге рака легкого.
Коронарный кальций, хроническая обструктивная болезнь лёгких, эмфизема являются ведущеми факторами ранней смертности, которые возможно выявить при помощи НДКТ.
Факторы риска, учитываемые при скрининге рака легкого.
- возраст
- заболевания лёгких (ХОБЛ, эмфизема, бронхит, пневмония, туберкулез).
- предшествующее онкологическое заболевание
- положительный семейный анамнез по раку легких
- контакт с асбестом.
Вред и польза, ассоциированные со скринингом рака легкого.
- Вред:
- Гипердиагностика
- Хирургическое вмешательство по поводу доброкачественных образований
- Психологический вред
- Лучевая нагрузка.
Минимизация вреда необходима для оправданности клинической эффективности хирургического вмешательства. По этой причине скрининг необходимо выполнять пациентам с высокими факторами риска. Выполнение исследования необходимо выполнять строго в скрининговых центрах с соблюдением полной методики НДКТ.
- Лучевая нагрузка со временем будет снижаться с приходом ультранизкодозовых КТ.
- Хирургическое вмешательство по поводу доброкачественных образований в данный момент составляет от 10% до 25%.
- Курящие пациенты должны быть проинформированы по поводу повышенных рисков развития рака легкого.

КТ методики, используемые в ранней диагностике рака легкого.
Сравнительная визуализация, демонстрирующая преимущество использования 3D волюметрии в сравнении с 2D измерениями при обнаружении легочных узлов.
В случае А представлен рост узла на 25% в объёме, что согласно критериям NELSON узел расценивается, как растущий (при оценке разницы диаметров - рост неубедительный (разница в 8%)). В случае В представлен рост узла на 25% в диаметре, а при оценке разницы объёма (времени удвоения времени) рост составил 95%. На таких простых примерах Field и соавторы доказали меньшую чувствительность диаметра по отношению к оценке объёма.

- По оси X представлен объём узла в мм3.
- По оси Y представлен средний диаметр в мм в аксиальной плоскости.
- Узлы со средним диаметром в 8-10 мм представлены во всех группах объёма. Узлы с данным диаметром являются наиболее неопределенными в плане тактики
В рамках пилотного проекта NLST дальнейшему наблюдению необходимо подвергать пульмонарные узлы более или равные 4 мм. Американский колледж Радиологии создал специальную группу, занимающуюся проблемами скрининга рака легкого Lung-Rads, которая разработала протоколы сканирования, описания и тактику последующих исследований.
При сравнении подходов к скринингу NLST и Lung-Rads было выявлено, что при Lung-Rads количество ложно-положительных результатов ниже, но при данном подходе чувствительность скрининга также снижается. Помимо этого Lung-Rads никогда не оценивали проспективно, поэтому модель Brock считается оптимальным для использования оценки риска злокачественности узла.
Современные рекомендации предусматривают полуавтоматическое определение узла с последующей оценкой объёма, в том числе определение времени удвоения объёма (VDT). Оправданность измерения узла в трёх размерах доказано в исследовании Henschke и соавторов и применялось в проектах NELSON и UKLS.

- По оси X представлен объём узла в мм3.
- По оси Y представлен средний диаметр в мм в аксиальной плоскости.
- Узлы со средним диаметром в 8-10 мм представлены во всех группах объёма. Узлы с данным диаметром являются наиболее неопределенными в плане тактики
В рамках пилотного проекта NLST дальнейшему наблюдению необходимо подвергать пульмонарные узлы более или равные 4 мм. Американский колледж Радиологии создал специальную группу, занимающуюся проблемами скрининга рака легкого Lung-Rads, которая разработала протоколы сканирования, описания и тактику последующих исследований.
При сравнении подходов к скринингу NLST и Lung-Rads было выявлено, что при Lung-Rads количество ложно-положительных результатов ниже, но при данном подходе чувствительность скрининга также снижается. Помимо этого Lung-Rads никогда не оценивали проспективно, поэтому модель Brock считается оптимальным для использования оценки риска злокачественности узла.
Современные рекомендации предусматривают полуавтоматическое определение узла с последующей оценкой объёма, в том числе определение времени удвоения объёма (VDT). Оправданность измерения узла в трёх размерах доказано в исследовании Henschke и соавторов и применялось в проектах NELSON и UKLS.
Измерение узлов при помощи волюметрии и оценка роста узла, сопоставляя предшествующие и нынешние объемы, является более достоверным в сравнении с измерениями выполненными в 2D, именно по этой причине в пилотном проекте NELSON следуют рекомендациям Британского торакального общества.
В данной статье представлены рекомендации Британского торакального общества (BTS) по тактике ведения пациентов с легочными узлами [1] от 2015 года.
Важной информацией из данной рекомендации является:
-
Наиболее оптимальный возраст для проведения скрининга является возраст от 55 до 80 лет.
- Для проведения повторного исследования узел должен составлять в размерах ≥⩾ 5мм или ⩾ 80mm3
- Сокращение периода повторного исследования до одного года для солидных узлов (5-6 мм).
- Данное руководство предусматривает две модели прогнозирования малигнизации при оценке легочных узлов.
- Данная рекомендация подходит, как к случайно выявленным узлам, так и к узлам выявленные в момент скрининга.
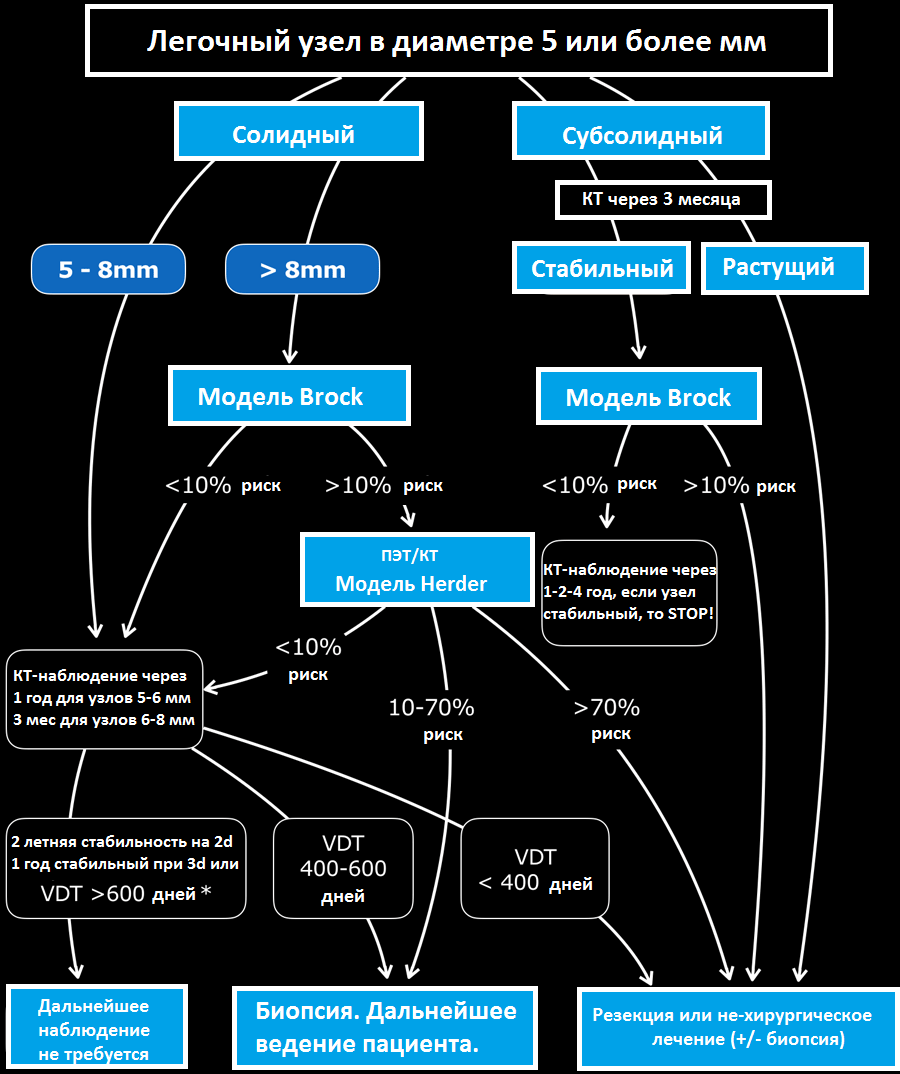
Представлена схема тактики ведения пациента, согласно рекомендациям Британского торакального общества.
Шаг 1
Повторное исследование не требуется, если узел в размерах < 5mm и для узлов, в которых присутствуют паттерн доброкачественной кальцификации и для таких типичных узлов, как гамартомы и перифиссуральные узлы.
Шаг 2
Повторное исследование требуется, если узел в размерах более, чем 5 мм. Принято разделять узлы на солидные и субсолидные (частично солидные и по типу матового стекла).
Шаг 3
Используйте модель Brock для оценки риска малигнизации солидных узлов в размерах более 8 мм и субсолидных узлов, которые стабильны в размерах в течение трех месяцев.
Шаг 4
Используйте модель Herder в случае, если требуется ПЭТ/КТ для оценки узла.
При использовании волюметрии повторные исследования проводятся в течение года, а при оценке узла в 2D режиме повторные исследования проводятся в течении 2 лет согласно рекомендациям BTS.
Узлы, которые в течение повторных исследований в размерах уменьшились более чем на 25%, рассматривают, как стабильные. Относите узлы к стабильным только, если показатель удвоения объема составляет >600 дней, при оценке волюметрии.
Оценка риска развития рака, основана на сравнении полученного и предшествующего исследования, используя (VDT-volume double time) показатель удвоения объема за период времени.
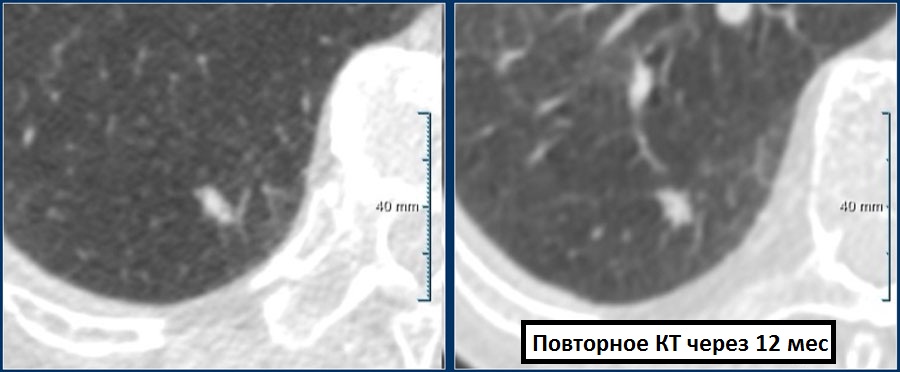
Пример 1
Одиночный солидный узел с не-спикулообразными контурами размерами 7 мм (162 мм3), визуализирующийся в нижней доле правого легкого, у 55-летнего мужчины, в семейном анамнезе которого нет онкологических особенностей, но при этом определяется незначительная эмфизема.
Последующее наблюдение показало долгосрочную стабильность: 7 мм (146 мм3) в течение 12 месяцев.
Пациенту не требуется дальнейшее КТ наблюдение.
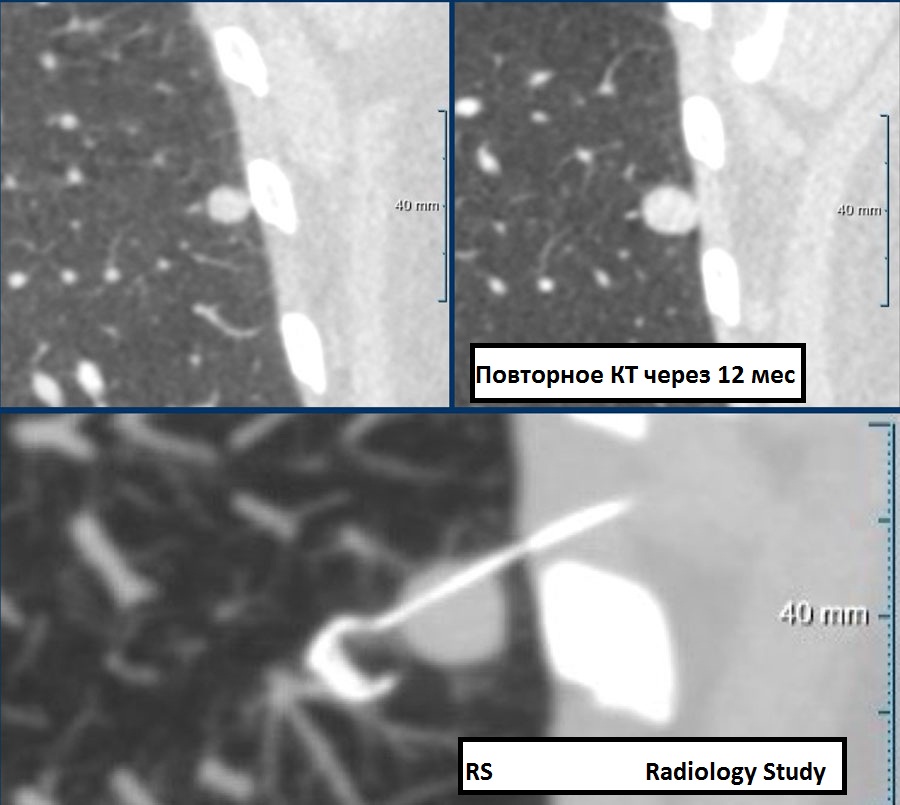
Пример 2
Одиночный солидный узел с не-спикулообразными контурами, размером 9 мм (362 мм3), визуализирующийся в нижней доле левого легкого у 75-летней женщины, у которой нет эмфиземы и в семейном анамнезе которой нет онкологических особенностей.
Прогноз риска малигнизации при помощи модели Brock составил 6.3%. Соответственно, данной пациентке требуется КТ наблюдение через 3 месяца, на котором узел оценен, как погранично стабильный, но при повторном исследовании на 12 месяц был запечатлен очевидный рост с показателем удвоения объема за период времени (VDT-volume double time) <400 дней.
После клиновидной резекции был установлен гистологически диагноз – карциноид.
Вы можете скачать калькулятор для модели Brock, модели Herder и для расчёта VBT. Ссылка.
С помощью калькулятора возможно:
1 - рассчитать вероятность малигнизации по модели Brock
2 - рассчитать вероятность малигнизации по модели Herder
3 - рассчитать VBT (Volume doubling time).
Вы также можете установить на своё iOS и Android устройство.

- По оси Х представлены объём наибольшего узла (мм3).
- По оси Y представлено время удвоения узла в объёма (VDT - Volume Double Time), измеряемый в днях.
- На диаграмме показан взаимосвязь объёма наибольшего узла и время удвоения узла в объёме в течении двух лет вовремя пилотного проекта NELSON.
По данным руководства BTS измерения узлов допускаются, как в 2D режиме, так и при использовании 3D волюметрии.
Обратите внимание, что при 2D измерении используется максимальный диаметр, а не среднее значение между диаметром в короткой и длинной оси, как в методе Fleischner.
В случае обнаружении множественных солидных легочных узлов, оценивайте риск и планируете последующую стратегию по наибольшему в размерах узлу.
Рост узла определяется, как увеличение в объеме на ≥25%.
Когда увеличение объема менее чем 25%, то узел относят к стабильным.
Примечания по использованию руководства по BTS для легочных узелов
- Руководство распространяется на субъектов ⩾18 лет.
- Получить тонкий срез КТ <1,25 мм и максимальное использование интенсивность-проекция (MIP) для того, чтобы увеличить обнаружение конкреций.
- В случае обнаружении множественных солидных легочных узлов, оценивайте риск и планируете последующую стратегию по наибольшему в размерах узлу.
- Когда оценка объема узла недоступна, то узел измеряется вручную, и за основной размер берется диаметр узла.
- При использовании объемной оценки узла рекомендовано наблюдение в течении 12 месяцев, в то время, как при измерении в ручном режиме рекомендовано наблюдение в течение 24 месяцев.
- Узлы размером < 5 мм / < 80 мм3 не требуют последующих наблюдений.
- Узлы, уменьшенные в объеме <25% , следует рассматривать, как стабильными. После рекомендованных повторных исследований данные узлы не наблюдаются.
- Относите узлы к стабильным только, если показатель удвоения объема за период времени (VDT-volume double time) составляет >600 дней (обязательно высчитан при использовании волюметрии) или по данным повторных КТ в зависимости от особенностей пациента.
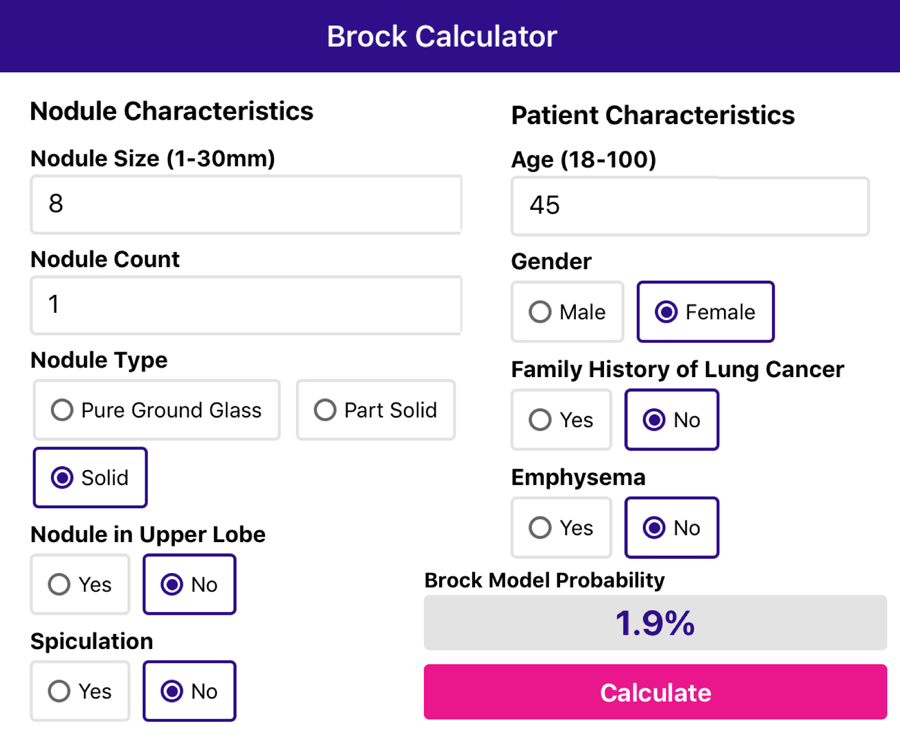
Модель Brock
McWilliams и коллеги разработали модель Brock для прогнозирования риска развития злокачественных новообразований легких [2].
Используйте приложение, чтобы заполнить характеристики узла и характеристики пациента, и оно рассчитает риск малигнизации.
Представлен клинический пример 45-летней женщины с солидным узлом без спикулообразных контуров, диаметром 8 мм, не расположенным в верхней доле.
Нет семейной истории рака легких и эмфиземы нет.
Приложение оценивает риск малигнизации в 1,9%.
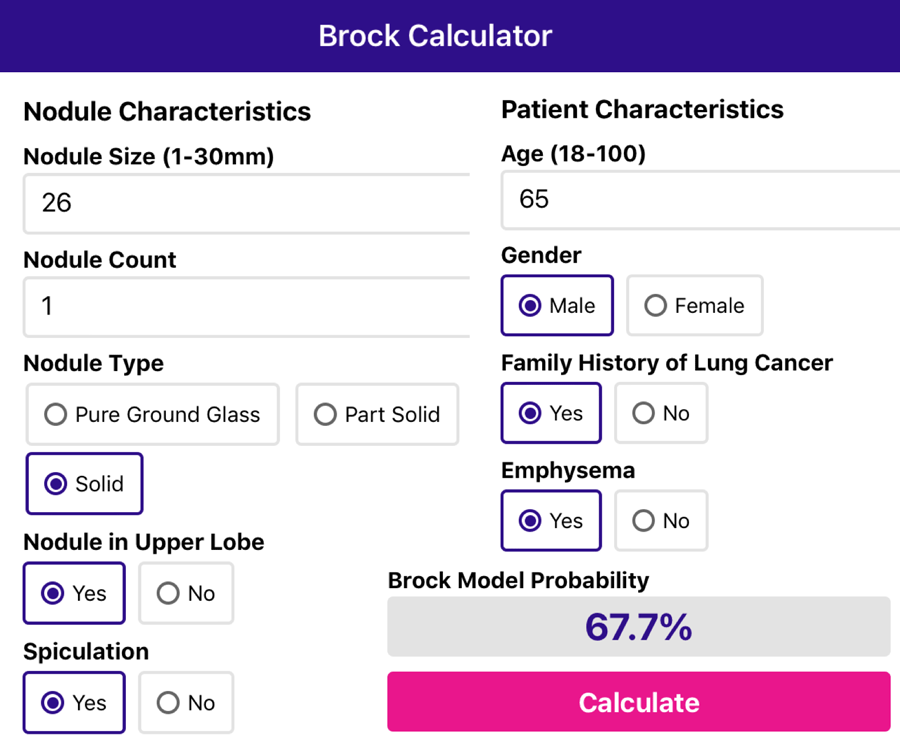
Еще один клинический пример 65-летнего мужчины с 26 мм солидным узлом, со спикулообразными контурами, расположенным в верхней доле.
Есть семейная история рака легких и эмфиземы.
Приложение рассчитывает риск малигнизации в 67,7%.
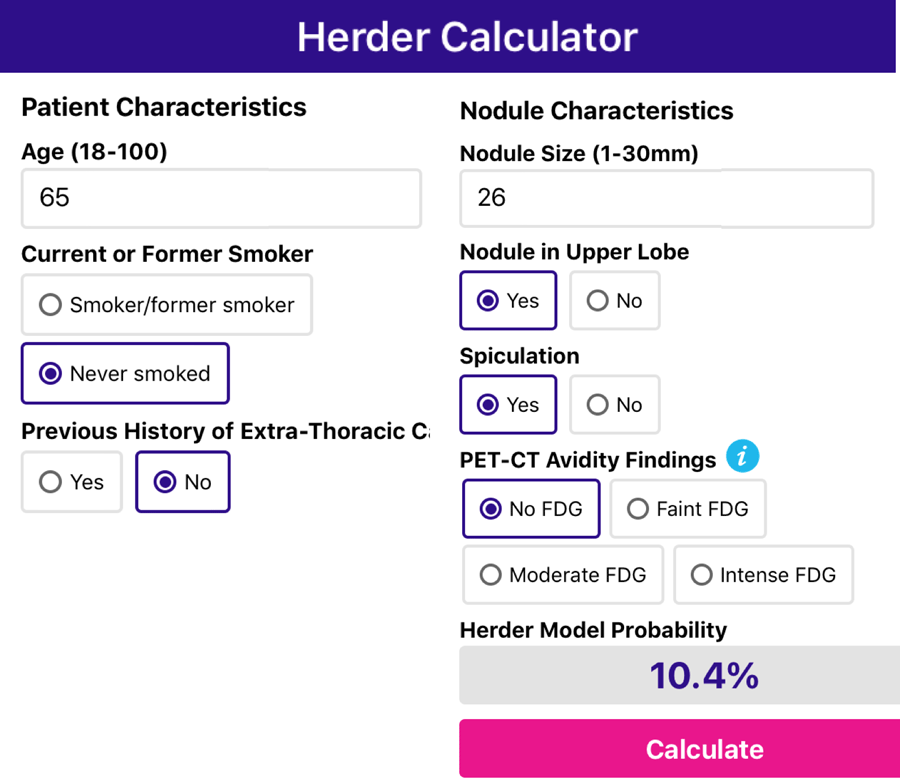
Модель Herder
Если риск малигнизации по модели Brock составил ≥10%, то риск малигнизации узла нужно оценить, используя модель Herder. В модели Herder используются данные ПЭТ/КТ, согласно руководству британскому торакальному обществу.
Для вычисления риска малигнизации калькулятор потребует от Вас:
- Данные пациента: возраст, статус курильщика, есть ли в анамнезе рак экстра-торакальной локализации.
- Характеристика узла: размер, верхняя доля, спикулы.
- ФДГ-активность накопления: нет, слабо, умеренно, интенсивно.
Данная модель показала превосходную эффективность [3], хотя эффективность ограничена для субсантиметровых узлов за счет разрешения ПЭТ/КТ.
Представлен пример использования модели Herder по данным 65 летнего пациента, к которому применяли выше модель Brock. Обратите Ваше внимание на тот факт, что риск малигнизации снизился с 67,7% до 10,4%, обусловленный тем, что нет накопления ФДГ в узле.
Рекомендации Европейского союза (ЕС):
Рекомендации, направленные на реализацию скрининга рака легких в Европе:
1. Низко-дозовое КТ является самым эффективным методом исследования раннего выявления рака легких, достоверно снижающим смертность от данной патологии. На основе данных, полученных в результате рандомизированных контролируемых исследований, в ЕС рекомендуется начать планирование скрининга рака легких в Европе с учетом рекомендаций, включающие данные NELSON по смертности и экономической эффективности, а также другие данные шести европейских исследований, направленные на разработку стратегий осуществления скрининга в каждой из своих стран.
2. Будущие программы скрининга рака легких при помощи низко-дозовой КТ должны использовать проверенный подход к стратификации риска, с тем чтобы обследовать только лиц, которые, как считается, находятся в достаточно высоком риске. В ближайшем будущем следует рассмотреть возможность включения потенциальных биомаркеров и генов восприимчивости в модели риска рака легких для повышения точности моделей стратификации риска.
3. Всем будущим обследуемым, принимающим участие в программах раннего выявления рака легких, следует предоставить тщательно разработанную информацию о потенциальных преимуществах и вреде скрининга, с тем чтобы они могли принять обоснованное решение о том, желают ли они участвовать в скрининге или нет. Совет по прекращению курения должен быть рекомендован всем активным курильщикам.
4. Последующая тактика ведения выявленных солидных узлов должна основана на полуавтоматическом измерении объема и последующей оценкой объёма-удвоения времени, что должно гарантировать качества.
5. Должен быть создан национальный совет по обеспечению качества профессиональными органами в целях соблюдения всех минимальных технических требований, в том числе полуавтоматической волюметрии, и стандартизировать диагностические критерии для выявленных во время скрининга пульмонарных узлов, а также предельно допустимые дозы облучения.
6. Тактика ведения узлов в легких в рамках скрининга КТ легких и обнаруженые вне скрининга должна осуществляться по-разному, что обусловленно разной вероятностью рака легких.
7. Несмотря на то, что имеются доказательства эффективности ежегодного скрининга рака легких с низкой дозой КТ, некоторые исследователи предполагают возможность использования более персонализированного подхода к скринингу рака легких то, есть с подходом, основанным на риске, на результатах базовых и первых раундов скрининга.
8. Тактика ведения узлов должна обсуждаться мультидисплинарно для того, чтобы минимизировать вред и оптимизировать качество лечения.
9. Группа экспертов из ЕС рекомендует начать планирование скрининга КТ с низкой дозой, поскольку скрининг рака легких при помощи НДКТ имеет потенциал для снижения смертности от данной патологии.
Призыв к действию:
ЕС должен установить сроки проведения скрининга рака легких:
- Разработка рекомендаций правильных измерений (6 месяцев)
- Планирование потребностей в медицинском обеспечении и их предоставление (12 месяцев)
- Планирование поэтапного внедрения в регионах с высоким риском, с параллельным ожиданием данных о смертности в пилотном проекте NELSON (18 месяцев)
- Планирование создания европейского реестра изображений и данных (18 месяцев)
- Оценить проекта после первых 12 месяцев и разработка дальнейшей стратегии (36 месяцев)
- Расширить скрининг рака легких во всех регионах Европы (48 месяцев)
Источники:
- European position statement on lung cancer screening - Matthijs Oudkerk, Anand Devaraj, Rozemarijn Vliegenthart, Thomas Henzler, Helmut Prosch, Claus P Heussel, Gorka Bastarrika, Nicola Sverzellati, Mario Mascalchi, Stefan Delorme, David R Baldwin, Matthew E Callister, Nikolaus Becker, Marjolein A Heuvelmans, Witold Rzyman, Maurizio V Infante, Ugo Pastorino, Jesper H Pedersen, Eugenio Paci, Stephen W Duffy, Harry de Koning, John K Field - www.thelancet.com/oncology Published online November 27, 2017 http://dx.doi.org/10.1016/S1470-2045(17)30861-6
- Radiology Assistant
- BTS Guidelines for the Investigation and Management of Pulmonary Nodules by Callister et al. Thorax 2015;70:ii1-ii54. DOI:10.1136/thoraxjnl-2015-207168
- Probability of cancer in pulmonary nodules detected on first screening CT by McWilliams et al. N Engl J Med 2013;369:910-9.
- Clinical prediction model to characterize pulmonary nodules: validation and added value of 18F-fluorodeoxyglucose positron emission tomography. by Herder et al. Chest 2005;128:2490-6