Гинекологический рак является распространенной неоплазией и составляет 10-15% от всех злокачественных новообразований у женщин (1). Задача визуализации до лечения является стадирование злокачественного процесса для дальнейшего планирования терапии и манипуляций. Задача визуализации после лечения (хирургических манипуляций, химиотерапии, лучевой терапии) являются оценка ответа на терапию. Компьютерная томография (КТ) является методом выбора для оценки рецидива рака яичника (2). Магнитно-резонансная томография (МРТ)—в частности, с динамической контрастированием имеет высокую чувствительность (91%) при выявлении рецидивов гинекологического рака (3).
Существуют различные онкологические варианты в гинекологии, в зависимости от локализации, гистологического типа, а также степени и стадии заболевания, поэтому важно, чтобы диагност был готов правильно оценить изображения пациентов после химиотерапии, лучевой терапии или их комбинации, интерпретируя исследование и избегая ошибок в дифференциации нормальной анатомии после лечения и рецидива заболевания.
Химиотерапия и лучевая терапия.
Химиотерапия чаще используется в качестве неоадъювантного лечения при высокодифференцируемом раке яичников, реже высокодифференцируемом раке шейки матки. Адъювантная химиотерапия используется после операции по поводу рака яичников и рака эндометрия. Первичные химиотерапия и лучевая терапия применяется для лечения распространенного рака шейки матки (2-4 стадии) (4). При эндометриальной карциноме лучевая терапия применяется после хирургического вмешательства у пациентов, у которых патологический процесс распространяется на миометрий или выходит за пределы матки. При раке яичников лучевая терапия рекомендуется только в качестве паллиативного лечения при IV стадии заболевания (4,5).
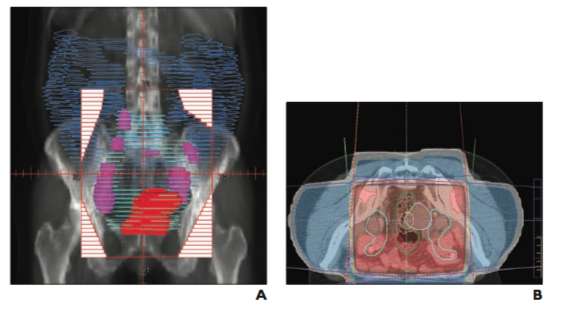
Планирование лучевой терапии.
Справа представлено пример оконтуривания рака шейки матки.
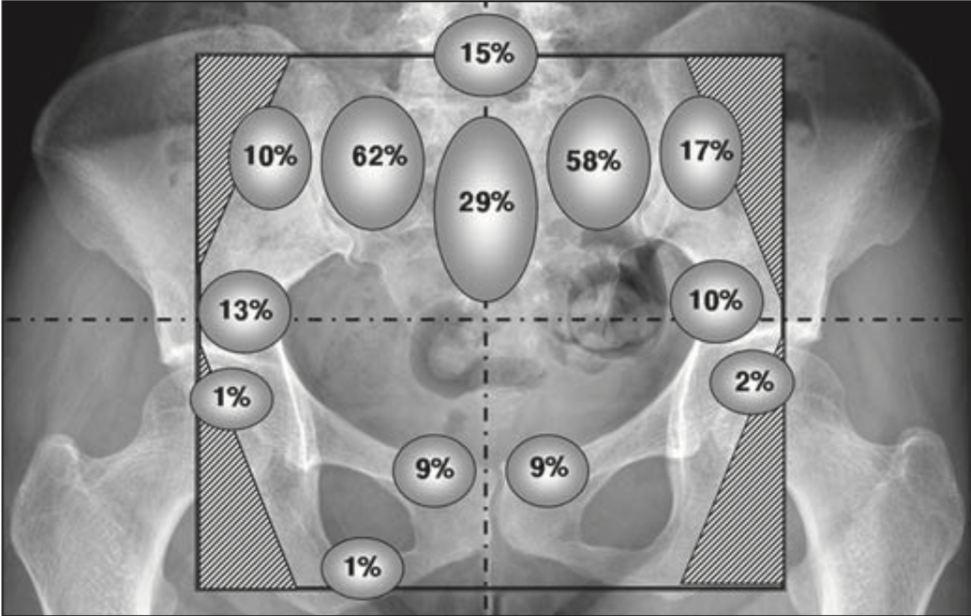
Схематическое распределение остеопоротических переломов костных структур малого таза, согласно статье Kwon J.W. и соавторов (6). Некоторые пациенты также имели множественные переломы.
Осложнения после лучевой терапии.
При отсутствии метастазов в регионарные лимфатические узлы лучевая терапия позволяет добиться полной или частичной регрессии опухоли, но при этом не следует забывать, что у 20% пациентов сформируются лучевые повреждения органов малого таза:
- мочевого пузыря,
- мочеточников,
- кишечника,
- влагалища,
- внутритазовой клетчатки,
- костно-мышечной системы (6).
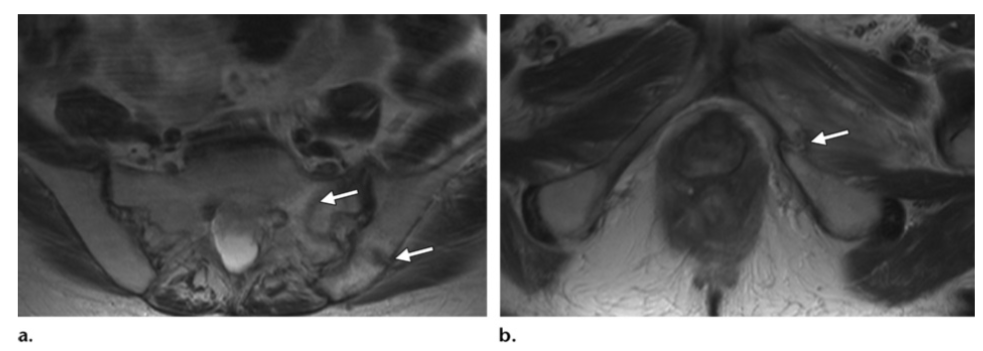
Остеопоротический перелом у 58-летней пациентки после лучевой терапии по поводу рака шейки матки (IIА). На рентгенограмме визуализируеются мозаичность и склероз в костных структур в области облучения, а также билатеральные переломы верхних ветвей лобковых костей. На КТ определяются аномальная структура подвздошной кости и остеопения крестца.
Изменения в костно-мышечной системе.
Лучевая терапия оказывает спектр изменений на костную ткань. Ранними изменения, выявленные на МРТ, являются замещение облученного костного мозга жиром, который возникает у 90% пациентов на 8 неделе после лучевой терапии (8).
Согласно исследования Kwon J.W. и соавторов остеопоротические переломы были выявлены у 100 из 510 пациентов (19,6%), в среднем спустя 16,9 месяцев после проведенной лучевой терапии, с наиболее частой локализаций переломов: тело крестца, крылья подвздошных костей, медиальная поверхность подвздошной кости, крыша вертлужной впадины, верхней ветви лобковой кости, головки бедренной кости и тела L5 позвонка. У 61% пациента были выявлены множественные переломы, а 40% двухсторонние симметричные переломы крыльев подвздошных костей. Другими осложнениями, обусловленными лучевой терапией, были остеолиз и аваскулярный некроз головки бедренной кости (6).
Спустя 3 года после окончания лучевой терапии у пациентки определяются остеопоротические переломы крестца, подвздошной кости, верхней ветви лобковой кости, визуализирующиеся на Т1-взвешенных изображениях, как гипоинтенсивные линии. Ложный сустав (несращение) является осложнением переломов верхней ветви лобковой кости.
Несмотря на то, что патологические изменения костных структур в данной группе пациентов возможно выявить на традиционной рентгенографии, которая является методом первой линии, данные осложнения чаще выявляются на повторных КТ или МРТ. КТ отлично визуализирует в костном режиме кортикальный слой. Ранние изменения определяются на МР-изображениях, проявляющиеся высоким сигналом на Т2-взвешенных изображениях, обусловленные отеком костного мозга, и линией перелома, имеющая гипоинтенсивный сигнал на Т1-взвешенных изображениях. Визуализация симметричных изменений не должно вызывать сомнения в диагнозе так, как остеопоротические переломы обычно симметричны (7). Остеосцинтиграфия чувствительна для выявления переломов, с характерным H-образным паттерном поглощения РФП в крестце, представляющим собой двусторонние переломы боковых масс крестца (32).
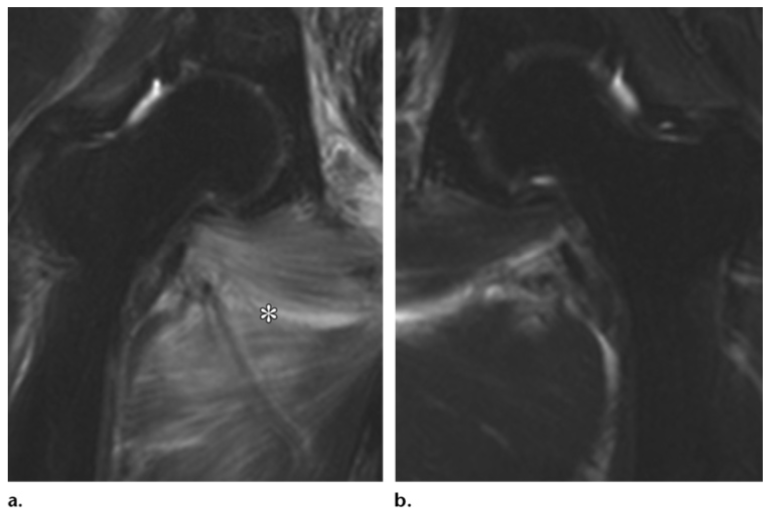
Миозит поперечно-полосатых мышц в пределах радиационного поля также является возможным осложнением, проявляющимся высокой интенсивностью сигнала на T2-взвешенных изображениях и усиливающимся после внутривенного введения контрастного вещества (5).
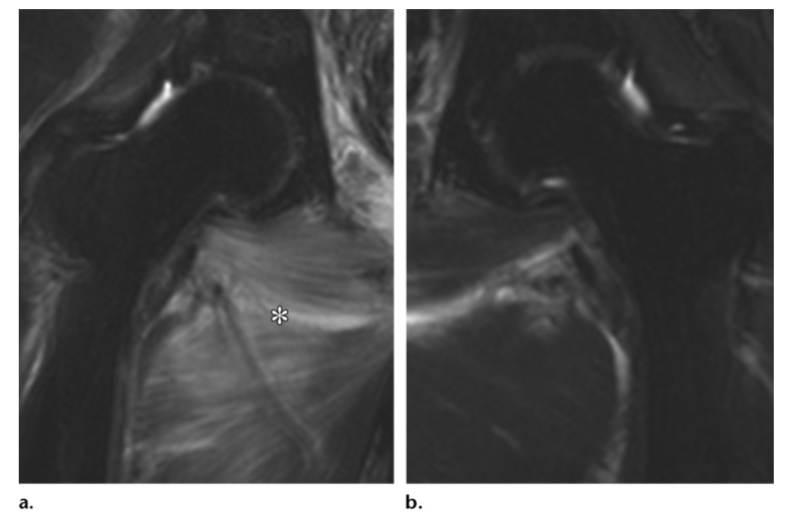
Миозит у 69-летней пациентки после лучевой терапии по поводу рака шейки матки (IIB). На корональных Т2-взвешенных изображениях определяется высокий сигнал от приводящих мышц. Данные изменения соответствуют миозиту, выраженному более справа.
Выводы:
Остеопоротические переломы костных структур таза, индуцированные радиотерапией, являются частым осложнением после лучевой терапии рака шейки матки. Если пациенты жалуются после радиотерапии по поводу гинекологического рака на боль в области таза, то остеопоротический перелом должен рассматриваться в качестве дифференциального диагноза. Знания, характерных паттернов при остеопоротических переломах, помогают отдифференцировать метастатическое поражение и нормальную анатомию структур таза после проведенной лучевой терапии. Наряду с вышеописанными изменениями после лучевой терапии развивается остеолиз и аваскулярный некроз головки бедренной кости.
Источники:
- 1.Kehoe S. Treatments for gynaecological cancers. Best Pract Res Clin Obstet Gynaecol 2006;20(6): 985–1000.
- 2.Funt SA, Hricak H, Abu-Rustum N, Mazumdar M, Felderman H, Chi DS. Role of CT in the management of recurrent ovarian cancer. AJR Am J Roentgenol 2004;182(2):393–398.
- 3.Kinkel K, Ariche M, Tardivon AA, et al. Differentiation between recurrent tumor and benign conditions after treatment of gynecologic pelvic carcinoma: value of dynamic contrast-enhanced subtraction MR imaging. Radiology 1997;204(1):55–63.
- 4.Delaney G, Jacob S, Barton M. Estimation of an optimal radiotherapy utilization rate for gynecologic carcinoma. I. Malignancies of the cervix, ovary, vagina and vulva. Cancer 2004;101(4):671–681.
- 5. Hricak H, Akin O, Sala E, Ascher S, Levine D, Reinhold C. Diagnostic imaging: gynecology. Salt Lake City, Utah: Amirsys, 2006.
- 6 AJR Am J Roentgenol. 2008 Oct;191(4):987-94. doi: 10.2214/AJR.07.3634. Pelvic bone complications after radiation therapy of uterine cervical cancer: evaluation with MRI. Kwon JW1, Huh SJ, Yoon YC, Choi SH, Jung JY, Oh D, Choe BK.
- 7. Sugimura K, Okizuka H. Postsurgical pelvis: treatment follow-up. Radiol Clin North Am 2002;40(3): 659–680, viii.
- 8. Blomlie V, Rofstad EK, Skjønsberg A, Tverå K, Lien HH. Female pelvic bone marrow: serial MR imaging before, during, and after radiation therapy. Radiology 1995;194(2):537–543.
- 9. Tai P, Hammond A, Dyk JV, et al. Pelvic fractures following irradiation of endometrial and vaginal cancers: a case series and review of literature. Radio- ther Oncol 2000;56(1):23–28.