Эмбриогенез
Венозная система в раннем эмбриональном периоде представлена двумя передними — правая и левая — и двумя задними кардиальными венами. Передние и задние кардиальные вены, сливаясь, образуют два протока Кювье1, впадающих в венозный синус сердца. Передние вены больше по диаметру, дистальные отрезки их соответствуют внутренним яремным венам, в которые впадают подключичные вены, формирующиеся при разви- тии верхних конечностей.
В процессе эмбрионального развития сердце перемещается в каудальном направлении, протоки Кювье при этом ориентированы продольно. Таким образом, в возрасте 2 мес у эмбриона имеются две ВПВ. Далее между ними начинает развивать- ся поперечный анастомоз — левая безымянная вена. К 5 мес внутриутробной жизни каудальная часть ВПВ, прилегающая к сердцу, образует общую пазуху сердечных вен, отрезок вены между этой пазухой и поперечным анастомозом частично или полностью запустевает. Одновременно исчезает часть левой кардиальной вены, идущая к сердцу. Дистальная часть правой кардиальной вены — правая безымянная вена — имеет почти вертикальное направление и, принимая левую безымянную вену, вместе с последней образует верхнюю полую вену.
Различные нарушения этих эмбриологических преобразований ведут к порокам развития венозной системы. Сохранение кровотока по обоим про- токам Кювье приводит к образованию двух ВПВ — левой и правой.
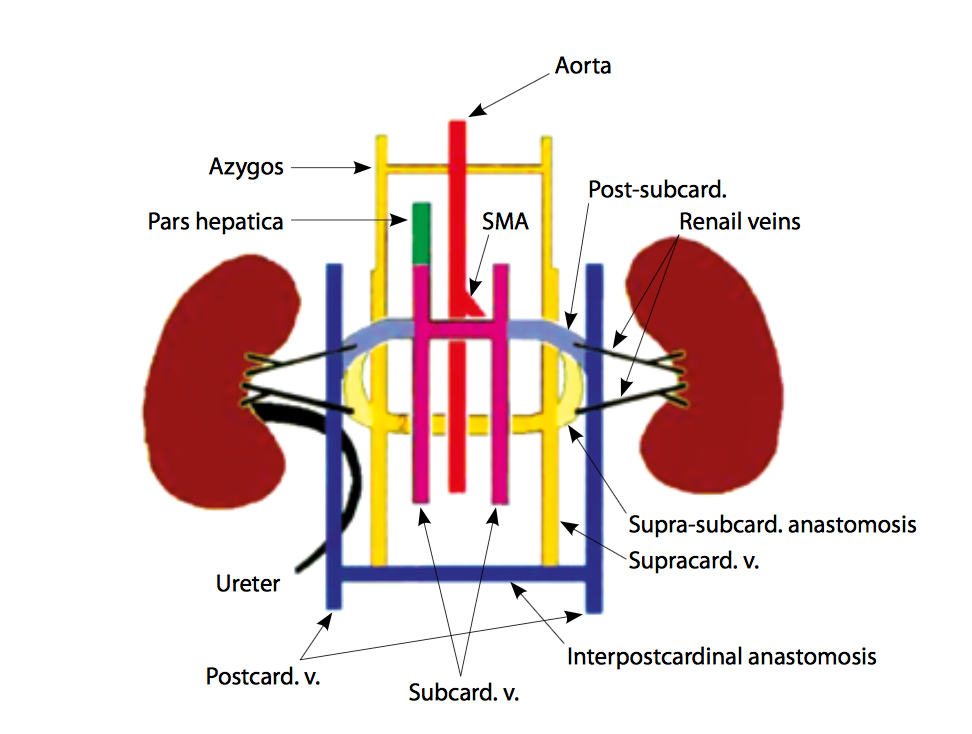
Схематическое представление эмбриогенеза нижней полой вены: aorta – аорта, SMA – верхняя брыжеечная артерия, post-subcard. anastomosis – анастомоз между посткардинальными и субкардинальными венами, renail veins – почечные вены, supra-subcard. anastomosis – анастомоз между супракардинальными и субкардинальными венами, supracard. v. – супракардинальная вена, interpostcardinal anastomosis – анастомоз между посткардинальными венами, subcard. v. – субкардинальная вена, postcard. v. – посткардинальная вена, ureter – правый мочеточник, pars hepatica – печеночный сегмент нижней полой вены, azygos – непарная вена.
Первое упоминание о вариантной анатомии нижней полой вены (НПВ) датируется 1793 г., когда J. Abernethy описал у 10-месячного младен- ца аномалию НПВ в виде отсутствия печеночного сегмента с венозным оттоком из нижней полови- ны туловища по системе непарной вены, сочета- ющуюся с полиспленией и декстракардией. В основе возникновения аномалий НПВ лежит сложный процесс развития её сегментов – печеночного, супраренального, ренального и инфраренального. С 6-й по 8-ю неделю эмбриогенеза сегменты НПВ формируются из трех первичных продольных систем субкардинальных, супракардинальных и посткардинальных вен в процессе их слияния, персистенции и инволюции.
Печеночный сегмент НПВ формируется из вен желточного сплетения,
- супраренальный – из правой субкардинальной вены, образуя анастомоз с печеночным сегментом,
- ренальный – из системы правых супрасубкардинальных и постсубкардинальных анастомозов,
- инфраренальный – из правой супракардинальной вены; дистальные отделы посткардинальных вен образуют общие подвздошные вены.
В случаях, когда последовательность формирования и слияния сегментов НПВ нарушена, возникают различные варианты аномалий НПВ.
Классификация
Аномалия нижней полой вены
- Постренальный сегмент
- Ренальный сегмент
- Преренальный сегмент
- Аплазия печеночного сегмента нижней полой вены с её продолжением в непарную вену
Источник
-
Аномалии развития нижней полой вены и ее притоков. Лучевая диагностика и клиническое значение Мельниченко Ж.С.1 • Вишнякова М.В.2 • Вишнякова М.В. (мл.)2 • Волкова Ю.Н.1 • Горячев С.В.1
DOI: 10.15690/onco.v2i2.1347
М.Ю. Рыков1, О.А. Кириллова1, В.В. Дайлидите1, Н.Н. Субботина1, Е.В. Михайлова1, В.А. Черкасов1, В.Г. Поляков1, 2
1 Российский онкологический научный центр им. Н.Н. Блохина, Москва, Российская Федерация
2 Российская медицинская академия последипломного образования Министерства здравоохранения Российской Федерации, Москва, Российская ФедерацияАномальное развитие верхней полой вены: клинический пример
- Radiopaedia
- 1. Bass JE, Redwine MD, Kramer LA et-al. Spectrum of congenital anomalies of the inferior vena cava: cross-sectional imaging findings. Radiographics. 20 (3): 639-52. Radiographics (full text) — Pubmed citation
- 2. Kellman GM, Alpern MB, Sandler MA et-al. Computed tomography of vena caval anomalies with embryologic correlation. Radiographics. 1988;8 (3): 533-56. Radiographics (abstract) — Pubmed citation
- 3. Padhani AR, Hale HL. Mediastinal venous anomalies: potential pitfalls in cancer diagnosis. Br J Radiol. 1998;71 (847): 792-8. Br J Radiol (abstract) — Pubmed citation
- 4. Chuang VP, Mena CE, Hoskins PA. Congenital anomalies of the inferior vena cava. Review of embryogenesis and presentation of a simplified classification. Br J Radiol. 1974;47 (556): 206-13. Br J Radiol (citation) — Pubmed citation
- 5. Bass JE, Redwine MD, Kramer LA, Huynh PT, Harris JH. Spectrum of congenital anomalies of the inferior vena cava: cross-sectional imaging findings. Radiographics : a review publication of the Radiological Society of North America, Inc. 20 (3): 639-52. doi:10.1148/radiographics.20.3.g00ma09639 — Pubmed